Latar belakang
Hewan berevolusi dan menempati berbagai niche ekologis dengan bantuan mikroorganisme (McFall-Ngai et al. 2013). Diperkirakan 10-20% spesies serangga memiliki simbion intraseluler, yang mungkin memainkan peran penting atau bermanfaat dalam perkembangan inang; hal ini telah dijelaskan pada kutu daun dan banyak serangga lainnya (Gil et al. 2004, Douglas 2007). Sebagai lingkungan yang relatif terbuka, usus sangat penuh oleh mikroba di sebagian besar serangga (Douglas 2011). Serangga juga mengembangkan struktur usus khusus untuk menampung simbion, seperti crypts dan hindguts yang diperbesar (Kikuchi et al. 2005, Nardi dan Bee 2012, Chapman et al. 2013). Telah diusulkan bahwa komunitas usus serangga dapat dibentuk oleh sistem kekebalan inang, mikrohabitat wilayah usus yang diciptakan oleh pH dan struktur, dan faktor lingkungan seperti diet dan tekanan lingkungan (Douglas 2011, Engel dan Moran 2013). Untuk beberapa serangga dengan perilaku sosial, seperti kecoak, lebah, dan rayap, ada transmisi mikrobiota usus antara individu dan keturunannya (Engel dan Moran 2013).
Ada bukti yang berkembang bahwa mikrobiota usus serangga memainkan peran penting dalam adaptasi inang dalam beberapa aspek termasuk pencernaan, nutrisi, pertahanan, reproduksi, dan metabolisme inang (Dillon dan Dillon 2004, Engel dan Moran 2013). Sebagai contoh, lebih dari 300 mikroba hidup berdampingan di hindgut rayap membantu pencernaan selulosa, fiksasi nitrogen, dan fermentasi karbohidrat (asam lemak rantai pendek), dan mikrobiota usus hidup berdampingan dengan spesies rayap (Warnecke et al. 2007, Hongoh 2011). Serangga yang menunjukkan plastisitas makanan (mis., Omnivora) pernah diyakini kurang bergantung pada simbion mikroba, karena serangga ini mampu memilih sendiri makanan yang optimal secara nutrisi dari lingkungannya (Buchner 1965). Dengan semakin banyak data eksperimental, simbion mikroba secara bertahap diketahui memainkan peran dalam memfasilitasi omnivora ini di sejumlah serangga seperti kecoak, jangkrik, carpenter ants, dll. (Kaufman dan Klug 1991, Gijzen dan Barugahare 1992, Feldhaar et al. 2007).
Larva Tenebrio molitor (L.) adalah serangga ekonomi penting, yang diproduksi secara massal untuk pakan hewan. Ini juga biasa digunakan sebagai model serangga untuk percobaan (Lord et al. 2012). Serangga ini termasuk omnivora dan dapat dengan cepat beradaptasi dengan banyak lingkungan. Para peneliti di Cina telah menguji cara-cara yang mungkin untuk memberi makan larva T. molitor pada sistem pendukung kehidupan bioregeneratif sebagai sumber protein hewani bagi manusia (Li et al. 2013). Midgut larva T. molitor adalah khusus dengan gradien pH mulai dari 5,2-5,6 hingga 7,8-8,2 dari bagian anterior ke posterior (Vinokurov et al. 2006, Prabhakar et al. 2007), dan hindgut memiliki struktur yang kompleks dengan fungsi reabsorpsi air dan nutrisi (Grimstone et al. 1968). Peneliti telah menyelidiki komunitas bakteri yang terkait dengan usus larva T. molitor menggunakan metode yang bergantung pada kultur (Culture-Dependent) dan denaturing gradient gel electrophoresis (DGGE), karena peneliti tertarik pada variasi komunitas bakteri di berbagai daerah usus dan interaksi antara inang dan mikrobiota usus.
Hasil Penelitian
Perbanyakan Bakteri Dari Usus Larva T. molitor
Rata-rata 0.29 ± 0.16 x 105, 1.28 ± 0.30 x 105, 1.38 ± 0.27 x 106, dan 6.64 ± 1.20 x 106 CFU (colony
forming unit) per usus dihitung masing-masing dalam foregut, midgut anterior, midgut posterior, dan hindgut, secara berurutan. Delapan spesies bakteri diisolasi secara total, seperti yang tercantum dalam Tabel 1. Menurut urutan rDNA 16-s mereka, mereka termasuk dalam filum Firmicutes dan Proteobacteria, termasuk lima genus: Weissella, Lactococcus, Rahnella, Cronobacter, dan Enterococcus. Lactococcus adalah genus yang paling melimpah dan menyumbang 40-50% dari semua koloni. Semua strain bakteri dapat ditemukan di midgut posterior dan hindgut, dengan Rahnella, Enterococcus, dan Cronobacter tidak ada di foregut dan dua yang terakhir tidak ada di midgut anterior juga. Kami tidak mendeteksi adanya strain bakteri yang menunjukkan aktivitas selulolitik. Aktivitas milk-clotting diidentifikasi dalam strain Weissella dan Lactococcus, yang merupakan bagian utama dari bakteri yang dikultur. Strain Rahnella dan Cronobacter menunjukkan aktivitas proteolitik.
Analisis DGGE dari Komunitas Bakteri di Berbagai Daerah Usus Larva T. molitor .
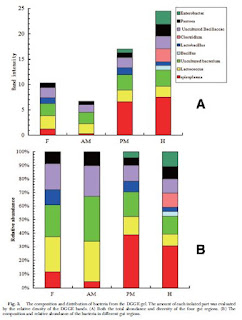
Sebanyak 20 band terisolasi diekstraksi dari gel DGGE. Semua band adalah gen bakteri kecuali band 17, yang merupakan kontaminasi dari gen inang (analisis BLAST menunjukkan ini adalah gen coleopteran 18S rRNA; semua analisis lebih lanjut meniadakan band ini). Di antara pita-pita ini (Gambar 2A dan Tabel 2), pita 1, pita 2, pita 3, pita 4, pita 10, dan pita 11 sangat cocok dengan bakteri yang tidak dikultur (DQ163951), dengan identitas urutan 98-100%. Bakteri ini dikaitkan dengan T. molitor dalam penelitian yang hanya menyebutkan informasi urutan ini sebagai kontrol (Dunn dan Stabb 2005). Urutan ini berafiliasi dengan Spiroplasma (94-95% identitas urutan). Band 7 dan band 8 sangat cocok dengan bakteri yang tidak dikultur (FN823944) yang terkait dengan Artemia sp. (crustacea Tkavc et al. 2011) dengan identitas urutan 96%. Afiliasi terdekat (87%) adalah Clostridium yang tidak dikultur (KP106087). Band 9 sangat cocok dengan Bacillus sp. (EF589780) dengan identitas urutan 98%, dan pita ini hanya terdeteksi di hindgut. Band 13 dan band 14, yang sekali lagi hanya di hindgut, terkait erat dengan Clostridium cellulovorans (CP002160) dengan identitas urutan 98%. Band 19 dan band 20, yang terdeteksi pada midgut posterior dan hindgut, sangat cocok dengan Enterobacter sp. (JQ917113) dengan identitas urutan 99%. Komposisi dan distribusi bakteri dalam usus larva T. molitor secara jelas diamati pada profil DGGE (Gambar 2A).
Dalam hal profil DGGE, indeks keanekaragaman Shannon umum masing-masing wilayah adalah F=0.7453, AM=0.6230, PM=0.7507, dan H=0.9002, secara berurutan. Spesies bakteri berada di tiga filum: Tenericutes, Firmicutes, dan Proteobacteria, dengan Firmicutes dominan di semua daerah usus, terhitung 79,47% (F), 85,03% (AM), 51,18% (PM), dan 49,28% (H) dari masing-masing spesies. Berdasarkan bagan kolom yang ditunjukkan pada Gambar. 3, jelas bahwa keanekaragaman dan kelimpahan bakteri berbeda antara empat daerah usus. Kami mengidentifikasi keragaman dan kelimpahan spesies bakteri tertinggi di hindgut (n=9 dan 41.83% dari seluruh komunitas), diikuti oleh midgut posterior (n=7 dan 29.03% dari seluruh komunitas), kemudian foregut (n=6 spesies dan 17.63% dari seluruh komunitas), dan midgut anterior (n=5 dan 11,52% dari seluruh komunitas). Hal itu jelas bahwa Spiroplasma menyumbang persentase besar bakteri di midgut posterior dan hindgut, proporsi yang masing-masing adalah 38,84% dan 30,74%. Proporsi Spiroplasma juga merupakan perbedaan utama antara midgut anterior dan midgut posterior. Serangga yang memakan dedak gandum yang disterilkan menyimpan lebih banyak Spiroplasma, yang mungkin mengindikasikan keunikannya. Analisis lebih lanjut PCA (Principle component analysis) (Gbr. 4, jarak antara simbol-simbol dalam diagram mendekati ketidaksamaan komposisi spesies mereka, diukur dengan jarak Euclidean mereka) menunjukkan bahwa komunitas bakteri dari empat daerah memiliki beberapa perbedaan. Forgut dan midgut anterior memiliki komposisi spesies yang mirip, dan komunitas bakteri midgut posterior lebih mirip dengan hindgut. Peneliti juga membuat perbandingan antara komunitas bakteri hindgut individu, mengungkapkan beberapa perbedaan antara individu dalam kondisi pemberian makanan yang sama berdasarkan pada keragaman pita dan kelimpahan dan analisis PCA (Gambar 2B dan 4).
Diskusi
Sebanyak 14 kelompok diidentifikasi dari usus larva T. molitor menggunakan metode culture-dependent dan DGGE. Metode DGGE mendeteksi lebih banyak spesies daripada metode culture-dependent pada kultur, tetapi di antara bakteri yang dikulturkan dengan kelimpahan rendah, Weissella, Rahnella, Cronobacter, dan Enterococcus tidak terdeteksi menggunakan metode DGGE. Di antara bakteri yang dapat dikultur yang terdeteksi, hanya Lactococcus yang sangat berlimpah yang dideteksi dengan metode DGGE. Ini menunjukkan bahwa metode DGGE dapat mengabaikan kelimpahan beberapa spesies sampai taraf tertentu, yang mungkin disebabkan oleh ekstraksi DNA dan prosedur amplifikasi PCR (Shi et al. 2010), atau sensitivitas gel DGGE itu sendiri dapat mempengaruhi hasilnya. Sementara spesies bakteri yang relatif sedikit dapat dibiakkan, DGGE tidak dapat mendeteksi beberapa strain yang dapat dibiakkan yang memiliki kelimpahan rendah. Di sini, kita mendapatkan representasi keseluruhan spesies yang lebih baik dengan menggunakan kedua metode ini. Band 8 dan 9 memiliki identitas rendah dengan spesies yang diketahui, menunjukkan bahwa ada beberapa spesies baru; selain itu, informasi wilayah V3 (16S rRNA) sangat terbatas (peneliti gagal membangun pohon filogenetik yang andal), sehingga diperlukan studi komprehensif tentang komunitas bakteri.
Komunitas bakteri usus serangga telah banyak dipelajari, dan keanekaragaman serta kelimpahannya menunjukkan variasi yang sangat besar. Jumlah spesies bakteri usus utama bervariasi dari satu hingga ratusan (Fukatsu dan Hosokawa 2002, Nakajima et al. 2005). Hasil penelitian ini menunjukkan bahwa komunitas bakteri usus T. molitor sangat sederhana. Ini sesuai dengan penelitian usus serangga dari serangga lain seperti larva lebah madu (Babendreier et al. 2007, Vojvodic et al. 2013), kutu daun (Haynes et al. 2003), semut singa (Dunn dan Stabb 2005), dan larva ngengat gipsi (Broderick et al. 2004). Rendahnya kompleksitas komunitas usus larva T. molitor mungkin disebabkan oleh lingkungan usus yang sederhana, efisien, dan terorganisir dengan baik (Grimstone et al. 1968, Vinokurov et al. 2006, Prabhakar et al. 2007). Meskipun pola keseluruhannya sederhana, kami masih dapat mengamati beberapa perbedaan dalam komunitas bakteri; ini mungkin adalah hasil dari kondisi fisik dan kimia yang kompleks yang menghasilkan perbedaan regional dari lingkungan usus (Egert et al. 2003, Lemke et al. 2003). Perlu dicatat bahwa komunitas bakteri pada hindgut dari larva T. molitor relatif beragam dan berlimpah, mirip dengan situasi di beberapa serangga lain seperti rayap, jangkrik, kecoak, dan beberapa kumbang di mana bakteri hindgut membantu pengembangan inang dengan berbagai cara. (Kaufman dan Klug 1991, Gijzen dan Barugahare 1992, Morales-Jime'nez et al. 2009, Hongoh 2011). Sebagai serangga omnivora, bakteri usus T. molitor mungkin penting untuk adaptasi inang terhadap makanan yang berbeda. Genta et al. (2006) menunjukkan bahwa mikrobiota usus mungkin memainkan peran halus dalam kehidupan T. molitor, yang terlibat dalam pencernaan makanan yang sulit dicerna (refraktori), detoksifikasi senyawa sekunder tanaman, dan memodifikasi profil volatile inang serangga. Namun, fungsi mikrobiota usus mungkin halus dan hanya terdeteksi dalam situasi tertentu seperti diet yang tidak seimbang dan lingkungan yang terkontrol (Dillon dan Dillon 2004, Lundgren dan Lehman 2010, Storelli et al. 2011): misalnya, kita tahu bahwa Pantoea aglomerat dalam usus serangga berpartisipasi dalam fiksasi nitrogen dan produksi fenol antijamur (Bridges 1981, Bridges et al. 1984, Dilion dan Charnley 1996, Vasanthakumar et al. 2006), sedangkan Lactobacillus, Clostridium, dan Bacillus adalah bakteri yang memfermentasi gula di beberapa Serangga Coleoptera (Rajagopal 2009). Dibutuhkan lebih banyak penelitian untuk menentukan peran mikrobiota dalam T. molitor.
Spiroplasma, biasanya dipandang sebagai simbion atau patogen pembunuh jantan dalam arthropoda (Gregory dan Francis 2000, Jung et al. 2014), tersebar luas pada serangga. Dalam penelitian ini, beberapa band dengan sedikit perbedaan urutan adalah milik Spiroplasma, menunjukkan kelimpahan dan heterogenitas; Namun, tidak ada urutan yang cocok dengan spesies apa pun dalam database. Penelitian sebelumnya pada komunitas bakteri usus T. molitor juga menunjukkan bahwa proporsi Spiroplasma cukup tinggi, di atas 90% dalam beberapa sampel (Jung et al. 2014). Para penulis ini juga menunjukkan bahwa setelah 10 hari memberi makan dedak dan tanah, bakteri usus dalam T. molitor didominasi oleh Spiroplasma; di sini dalam penelitian ini, larva T. molitor yang dipelihara dengan dedak gandum yang disterilkan juga lebih banyak mengandung Spiroplasma di hindgut. Memperhatikan kurangnya laporan tentang Spiroplasma yang menempati usus serangga, Jung et al. (2014) mengemukakan bahwa prevalensi mereka di usus mungkin merupakan situasi yang tidak biasa di antara serangga. Peneliti juga menemukan bahwa urutan Spiroplasma terkait erat (97-98%) dengan tenebrionid omnivora lain, Gonasida inferna (Casey) (Colman et al. 2012), meskipun penulis tidak menyebutkan kelimpahan genus. Kita bisa menyimpulkan bahwa Spiroplasma dapat diwariskan dan berdampingan dengan usus T. molitor, atau mereka hanya lebih kompetitif daripada spesies bakteri lainnya. Terlepas dari peraturan reproduksi, Spiroplasma dapat membawa peningkatan resistensi terhadap infeksi nematoda di Drosophila (Jaenike et al. 2012) dan meningkatkan kemampuan overwintering pada wereng Dalbulus maidis (DeLong & Wolcott) (Ebbert dan Nault 1994). Potensi peran Spiroplasma dalam T. molitor harus dieksplorasi lebih jauh karena mereka tampaknya tidak berbahaya bagi inang (mereka patogen terhadap beberapa serangga seperti lebah madu) dan tidak menunjukkan karakterisasi pembunuhan jantan.
Komunitas bakteri usus dapat dibentuk oleh diet tertentu. Contoh kasus adalah bahwa beberapa bakteri selulolitik diisolasi dari usus larva T. molitor setelah perawatan dengan limbah lignoselulosa selama 2 minggu (Qi et al. 2011). Tetapi dalam penelitian ini, peneliti tidak mendeteksi bakteri selulolitik yang dapat dikultur di lingkungan aerob. Ini sedikit banyak mencerminkan proses evolusi bersama interaksi serangga-mikroba. Mikroba yang telah mengadopsi gaya hidup endosimbiotik tidak hanya telah berevolusi untuk hidup di habitat khusus dalam organisme hidup, tetapi habitat hidup juga telah berevolusi untuk mengakomodasi mereka (Nardi et al. 2006). Karena beberapa bakteri proteolitik dan bakteri yang memproduksi chymosin dikultur, peneliti membuat perbandingan aktivitas midgut protease dan aktivitas chymosin antara serangga yang dipelihara secara konvensional dan serangga yang diobati dengan antibiotik (data tidak ditunjukkan). Aktivitas chymosin jauh lebih tinggi setelah perawatan. Tetapi peneliti tidak sepenuhnya memahami fenomena ini. Seperti penelitian sebelumnya (Jung et al. 2014), peneliti juga melakukan upaya untuk mengkloning nifH dan gen selulase tetapi gagal. Upaya penelitian lebih lanjut harus dilakukan untuk memperjelas peran komunitas bakteri usus dalam efisiensi tinggi pemanfaatan makanan dan kapasitas adaptasi yang sangat baik dari T. molitor.
Sumber : Wang Y, Zhang Y. 2015. Investigation of Gut-Associated Bacteria in Tenebrio molitor (Coleoptera: Tenebrionidae) Larvae Using Culture-Dependent and DGGE Methods. Ann. Entomol. Soc. Am. 1–9 (2015); DOI: 10.1093/aesa/sav079




Posting Komentar untuk "Investigasi Bakteri yang Berasosasi dengan Usus Larva Tenebrio molitor (Coleoptera: Tenebrionidae) Menggunakan Metode Culture-Dependent dan DGGE"